Alertes
Produits à base d’hydroxyethylamidon (Voluven®)
Les hydroxyethylamidons (HEA), produits de substitution volémique colloïdal synthétique sont parmi les solutés administrés par voie intraveineuse pouvant être utilisés en réanimation par fluides.
Ils favorisent la rétention d’eau, augmentant ainsi le volume plasmatique, permettant le contrôle des chutes du débit sanguin et la baisse de la tension artérielle.
Les HEA sont utilisés depuis plus de 20 ans dans les hôpitaux de tous les pays. Les molécules d’HEA possèdent des caractéristiques physico-chimiques différentes leur conférant des propriétés pharmacocinétiques particulières.
Plusieurs études menées concernant l’emploi de l’HEA ont montré une augmentation de la mortalité comparée à d’autres produits ainsi qu’une augmentation des risques d’insuffisances rénales expliquant certaines mortalités.
D’autres études n’ont pas montré ce type d’effets indésirables.
Afin de sécuriser l’emploi de l’HEA, des contre-indications d’HEA ont été émises, à savoir :
- Les patients présentant une septicémie ;
- Les patients présentant des troubles hépatiques graves ;
- Les patients présentant une déficience rénale avec oligurie et anurie, non liée à l’hypovolémie.
De ce fait, l’utilisation clinique de l’HEA dans le cas de réanimation volumique aiguë n’est pas justifiée en raison de graves problème de sécurité.
Une prudence particulière lors de l’emploi de ces solutions est de rigueur auprès de patients atteints de troubles rénaux.
En pratique : Les patients nécessitant des soins intensifs ou d’urgence, l’utilisation de cristalloïdes plutôt que des solutions à base d’HEA doit être évaluée.
Dernière Mise à jour : Mai 2018
Hydroxyde ferrique dextran (Cosmofer®) Solution Inj.50mg/ml
Le fer dextran expose à plus d’hypersensibilités que les autres spécialités à base de fer injectables disponibles, sans bénéfices supplémentaires.
Pour une anémie par carence martiale, le fer oral constitue le traitement de choix.
La voie parentérale est à réserver aux patients en échec thérapeutique suite à l’utilisation du fer oral.
Les effets indésirables communs aux différentes spécialités à base de fer intraveineux sont :
- Les troubles cutanés (urticaires, rashs, prurits) ;
- Les nausées ; la fièvre ; les myalgies ; les arthralgies ; etc.
- Les réactions d'hypersensibilité, menaçant parfois le pronostic vital, sont plus fréquentes avec le fer dextran qu’avec le fer saccharose.
En 2010, la commission de pharmacovigilance française a étudié les réactions allergiques au fer intraveineux, à partir des rapports périodiques actualisés de sécurité (PSURs), le taux de notification de réactions d'allure allergique a été de 14,1 pour 100 000 patients avec le fer dextran versus 3,9 avec le fer saccharrose ; et de 2,9 versus 0,26 pour les réactions menaçant le pronostic vital.
Dans la base de données de pharmacovigilance française, le nombre d'effets indésirables notifiés rapporté au nombre d'années de commercialisation a été plus élevé avec le fer dextran, la survenue plus rapide et les conséquences cliniques plus graves.
Selon les données de l'Organisation Mondiale de la Santé (OMS) entre 2001 et 2003, les notifications ont été plus nombreuses et la gravité plus importante avec le fer dextran.
En pratique : Aucune situation ne justifie de préférer le fer dextran aux autres spécialités à base de fer intraveineux, notamment le fer saccharose, la référence.
Réf :
1-‘’Iron’’. In :’’M artindale the complete drug reference’’ The Pharmaceutical press, London .Site www.medicinescomplete.com consulté le 23 janvier 2009 12 pages
2- Prescrire Rédaction ‘’Fer saccharose IV. Pour les rares cas ou la voie orale ne convient pas’’Rev Prescrire 2009 ;29 (306) :262.
3-Prescrire Rédaction ‘’fer dextran intraveineux-Ferrisat®.Trop de réactions anaphylactiques graves’’Rev Prescrire 2009 ;29 (307) :338.
4-Afssaps ‘’RCP +notice-Ferrisat’’ 23 avril 2008+’’RCP-Venofer’’ 5 juillet 2011 +’’RCP- Ferinject’’15mars 2012 :8+6+8+7 pages.
5-Prescrire Rédaction ‘’Fer dextran :trop d’hypersensibilités’’ Rev Prescrire 2011 ;31 (335) :668.
6-‘’Iron’’ +’’Iron dextran’’.In :’’ Martindale The complete drug reference’’The Pharmaceutical Press.London. Site www.medicinescomplete.com consulté le 29 juin 2012:23+10 pages.
7-La revue Prescrire Février 2015/Tome 35 N° 376.page 149
8-HAS ‘’Commission de la transparence-Avis- Ferrisat 50 mg/ml, solution injectable pour perfusion ‘’19 janvier 2011.Site www.has-sante.fr consulté le 11 janvier 2011 :8 pages
9-Prescrire rédaction’ fer polymaltose intraveineux-Ferinject®.3 fer intraveineux : prudence’’Rev Prescrire 2011 ;31 (328) :97 +(329) :II de couverture.
10-HAS –commission de la transparence ‘’Avis- ferrisat’’ 11avril 2012 +compte(s)rendu(s) de (s) réunion (s) du 20 octobre 2010+19 janvier 2011+27 avril 2011+08 juin 2011 +30novembre 2011 +28 mars 2012+11 avril 2012 : 115 pages au total.
11-‘’Arrêté du 3 juillet 2012 portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage de collectivités’’Journal Officiel du 10 juillet 2012 : 2 pages.
Amphotéricine B injectable
Information destinée aux professionnels de la santé.
Objet : Amphotéricine B injectable, risques d’erreurs.
Le Centre National de Pharmacovigilance et de Matériovigilance (CNPM) attire l’attention des praticiens sur le risque d’erreurs de prescription, de dispensation, de préparation ou d’administration des trois formes d’amphotéricine B injectable dont les posologies sont différentes.
Il existe une forme dite conventionnelle d’amphotéricine B, le désoxycholate d’amphotéricine B (Fungizone°) ; et deux formes lipidiques : un complexe phospholipidique (Abelcet°) et une forme liposomale (AmBisome°). Ces deux dernières spécialités ne sont pas encore disponibles en Algérie .
Les erreurs concernent principalement l’administration de Fungizone® à la place d’AmBisome®, à la posologie et au débit d’administration de ce dernier , ayant pour conséquence un surdosage en amphotéricine B, pouvant entrainer de graves atteintes cardiaques ou rénales.
Recommandations d’utilisation :
- Non interchangeabilité des médicaments injectables à base d’amphotéricine B : il n’est pas possible de substituer une spécialité à base d’amphotéricine B par une autre.
- Importance de prescrire les médicaments en DCI (dénomination commune internationale) et en nom de marque afin d’éviter tout risque de confusion entre les différentes formulations d’amphotéricine B (à cette date il n’existe pas encore de générique de ces spécialités en Algérie).
- Rappel des modalités spécifiques de préparation et d’administration :
- Fungizone® et AmBisome : reconstitution avec de l’eau PPI uniquement.
- Abelcet® suspension : pas de reconstitution.
- Abelcet®, Fungizone® et AmBisome: dilution avec une solution injectable de glucose uniquement.
- Il est important de rappeler que l’amphotericine B n’est pas compatible avec le chlorure de sodium (NaCl) à 0,9% ou les solutions contenant des bactériostatiques.
- Ne pas mélanger avec d’autres traitements ou électrolytes. Ces spécialités ne doivent pas être administrées par une ligne intraveineuse ayant contenu du chlorure de sodium à 0,9% sauf si cette ligne a d’abord été rincée avec une solution injectable de glucose.
Tableau comparatif des RCP des spécialités injectables à base d’amphotéricine B
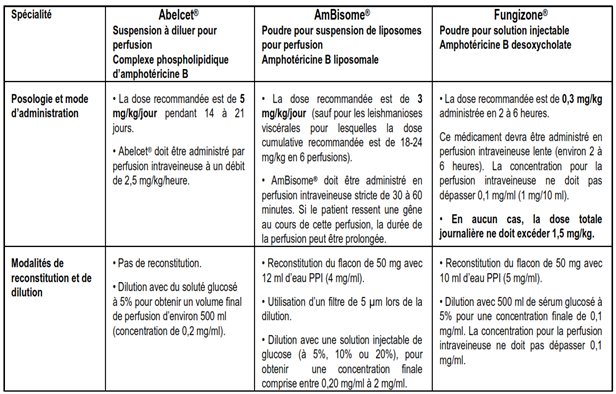
Il est important de lire attentivement et de suivre les instructions présentées sur l’étiquette du flacon et sur l’étui avant de réaliser la reconstitution et la dilution d’une spécialité injectable à base d’amphotéricine B.
En pratique :
Prescrire, dispenser (étiqueter la perfusion) et administrer en différenciant les formes : désoxycholate d’amphotéricine B (Fungizone°), complexe phospholipidique d’amphotéricine B (Abelcet°) et liposomes d’amphotéricine B (AmBisome°), dans ces situations à risque élevé d’erreur, l’expression en dénomination commune internationale (DCI) est utile, ne pas préciser la spécialité est dangereux.
Tout effet indésirable suspecté d’être dû à un médicament dont les professionnels de la santé ont connaissance est à déclarer au Centre National de Pharmacovigilance et de Matériovigilance (www.cnpm.org.dz).
Dernière Mise à jour : Mai 2018
DOMPERONE - CNPM - FACEBOOK 2.0
Centre National de Pharmacovigilance et de Matériovigilance (CNPM) rappel de lot #DOMPERONE® de #PHARMALLIANCE
Dans le cadre de la Pharmacovigilance, le Ministère de la Santé, de la Population et de la Réforme Hospitalière (Courrier Ref : 28/MSPRH/DPP/SDPPP/2018), a demandé au laboratoire PHARMALLIANCE d’effectuer un rappel de lot N° : 021/17, DCI : Dompéridone (DOMPERONE®), comprimés pelliculés à 10mg, boite de 40 (Motif : Rappel volontaire effectué par le laboratoire), au niveau des services utilisateurs tant que publics que privés (Officines et établissements de santé), et de façon générale du circuit de commercialisation, et son remplacement par un lot conforme.
Dernière Mise à jour : Juin 2018
Lot contrefait en circulation sur le marché Algérien : Cialis (Tadanafil°)
Nous portons à votre connaissance qu’un lot contrefait du Cialis (Tadanafil°) est en circulation sur le marché Algérien : Cialis (Tadanafil°) boite de 04 Cp, N° de lot A768632, date de FAB : 11/2010, date d’EXP : 10/2013.
CNPM le, 29 juillet 2012
Dernière Mise à jour : Mars 2017
Localisation du CNPM
Photo du centre

Contacter nous
CNPM, Sis Route Petit Staoueli (NIPA) Dely Ibrahim Alger, Tél. / Fax : 00 213 20 39 66 18 / 00 213 20 39 66 16
Mail : cnpm@cnpm.org.dz






