Alertes
Quinolones et fluoroquinolones, administrés par voie systémique ou inhalée : risque d’effets indésirables invalidants, durables et potentiellement irréversibles et restrictions d’utilisation.
Les quinolones et les fluoroquinolones sont des antibiotiques administrés par voie systémique ou par voie inhalée, utilisés pour traiter des infections bactériennes au cours desquelles le pronostic vital peut être engagé.
Bien qu’ils soient rares, des effets indésirables graves, durables, invalidants et potentiellement irréversibles, affectant principalement le système musculo-squelettique et le système nerveux ont été rapportés avec les antibiotiques de la famille des (fluoro) quinolones. En conséquence, la balance bénéfices-risques de tous les antibiotiques de ces deux familles ainsi que leurs indications au sein de l’Union Européenne ont été réévalués.
Les effets indésirables affectant le système musculo-squelettique sont : tendinite, rupture de tendon, douleurs musculaires, faiblesse musculaire, arthralgie, gonflement articulaire et troubles de la marche.
Les effets indésirables affectant le système nerveux périphérique et le système nerveux central sont : neuropathie périphérique, insomnie, dépression, fatigue, troubles de la mémoire ainsi que troubles de la vue, de l’audition, de l’odorat et du goût.
Les médicaments à base de (fluoro) quinolones ne doivent pas être prescrit pour :
1-Traiter des infections non sévères ou spontanément résolutives (par exemple : pharyngite, angine et bronchite aiguë) ;
2-Prévenir la diarrhée du voyageur ou les infections récidivantes des voies urinaires basses ;
3-Traiter des infections non bactériennes. Exemple, la prostatite chronique non bactérienne ;
4-Traiter des infections de sévérité légère à modérée (notamment cystite non compliquée, exacerbation aiguë de la bronchite chronique et de la broncho-pneumopathie chronique obstructive [BPCO], rhino-sinusite bactérienne aiguë et otite moyenne aiguë), à moins que les autres antibiotiques habituellement recommandés pour ces infections ne soient jugés inappropriés ;
5-Traiter des patients ayant déjà présenté des effets indésirables graves avec un antibiotique de la famille des quinolones ou fluoroquinolones.
En pratique, la prescription des médicaments à base de (fluoro) quinolones ne doit être faite qu’après une évaluation individuelle approfondie de la balance bénéfices-risques pour chaque patient. L’information des prescripteurs et des malades, la surveillance des effets indésirables du traitement est primordiale afin d’éviter les risques liés au traitement.
Bibliographie :
1-ʺAntibiotiques de la famille des quinolones et fluoroquinolones administrés par voie systémique ou inhalée : risque d’effets indésirables invalidants, durables et potentiellement irréversibles et restrictions d’utilisation - Lettre aux professionnels de santéʺ. www.ansm.santé.fr. 07 pages. Consulté le 15/04/2019.
2- ʺMédicaments contenant de la quinolone et de la fluroquinoloneʺ https://www.ema.europa.eu/en/medicines/human/referrals/quinolone-fluoroquinolone-containing-medicinal-products. 03pages. Consulté le 15/04/2019
3-ʺLes fluoroquinolonesʺ.https://www.uptodate.com/contents/search. . 34 pages. Consulté le 23/04/2019
4-ʺ Fluoroquinolonesʺ. Guide des interactions médicamenteuses. Rev prescrire 2018. (322): 479-480.
Dernière mise à jour : Mai 2019
Fluroquinolones par voie systémique ou inhalée: risque de survenue d'anévrisme et de dissection aortique
Les quinolones et les fluoroquinolones sont des antibiotiques administrés par voie systémique (forme injectable ou orale) ou par voie inhalée, utilisés pour traiter des infections bactériennes au cours desquelles le pronostic vital peut être engagé.
L'anévrisme et la dissection aortique sous fluoroquinolones sont des effets indésirables rares et graves.
Les fluoroquinolones utilisées par voie systémique ou inhalée peuvent augmenter le risque de survenue d'anévrisme et de dissection aortique, en particulier chez les personnes âgées.
Les facteurs de risque de leur survenus comprennent :
1- Des antécédents familiaux d’anévrisme ;
2- Des antécédents d’anévrisme ou de dissection aortique ;
3-Le syndrome de Marfan ;
4-Le syndrome vasculaire d’Ehlers-Danlos ;
5-L’artérite de Takayasu ;
6-L’artérite à cellules géantes (maladie de Horton) ;
7-La maladie de Behçet ;
8-L’hypertension artérielle et l’athérosclérose.
Les patients doivent être informés de ce risque et doivent être avertis de la nécessité d’une prise en charge médicale immédiate en cas d’apparition brutale d’une douleur intense abdominale, thoracique ou dorsale.
En pratique, les fluoroquinolones ne doivent être utilisées chez les patients présentant un risque de survenue d'anévrisme et de dissection aortique, qu'après une évaluation attentive de la balance bénéfices-risques et après prise en compte des alternatives thérapeutiques.
Bibliographie :
1-ʺFluoroquinolones par voie systémique ou inhalée : risque de survenue d’anévrisme et de dissection aortiqueʺ. www.ansm.santé.fr. 02 pages. Consulté le 24/04/2019.
2-ʺ Fluoroquinolonesʺ. Guide des interactions médicamenteuses. Rev prescrire 2018. (322): 479-480.
Dernière mise à jour : Mai 2019
Méthotrexate par voie orale: attention aux surdosages
Le méthotrexate par voie orale est prescrit depuis des années en rhumatologie pour le traitement de certaines formes de polyarthrites rhumatoïdes et de psoriasis (5).
Le méthotrexate est à utiliser avec précaution en raison d’effets indésirables parfois graves doses dépendants (1, 2, 3).
Des patients ont été gravement intoxiqués suite à une surdose ; chez la moitié de ces patients la surdose a été la conséquence d’une erreur de prise de la dose prescrite, une fois par jour au lieu d’une fois par semaine (1, 2, 3).
La connaissance des signes précoces d’une éventuelle intoxication (syndrome pseudo grippal, nausées, vomissements, diarrhée, toux sèche, douleurs dans la poitrine, difficultés respiratoires, plaies de la peau et des muqueuses), par le patient et son entourage est d’importance capitale pour éviter les conséquences graves de surdosage qui sont parfois fatales (1, 2, 3).
Pour éviter un risque de surdosage, des mesures de sécurité sont à mettre en œuvre lors d’un traitement par méthotrexate :
Mesure à l’attention des patients :
- Noter sur la boite le jour de la semaine et le nombre de comprimés à prendre et la date de la première prise.
- Tenir à jour, une fiche de suivi indiquant le nombre de comprimés (initial, pris et restant).
- Recompter le nombre de comprimés restant. En cas de doute, il est préférable de ne pas prendre le méthotrexate.
- Signaler immédiatement au médecin tout signe susceptible d’être dû à un surdosage.
- Informer les soignants lors de la prise du méthotrexate, et présenter les documents (ordonnance et bilans) en cas d’hospitalisation ou de consultation (1, 2, 3).
Mesure à l’attention du prescripteur :
- Bénéficier d’une attention particulière, pour patients âgés et/ou présentant des troubles cognitifs.
- Préciser sur l’ordonnance le jour de la semaine de prise du médicament. Aucune abréviation ne doit être utilisée pour désigner le jour de la semaine prévu pour l'administration (4).
Mesure à l’’attention du laboratoire fabriquant :
- Mettre une information lisible sur l’emballage du médicament dans un encadré rouge figurément sur les boîtes de ce médicament stipulant que le médicament ne doit pas être pris tous les jours (5).
Bibliographie :
- 20-1-4.patient sous méthotrexate ʺRev prescrire2017 ; 37 (401 suppl.interactions médicamenteuses).
- méthotrexate oral à 10mg : attention aux surdoses avec dosage fort,et un conditionnement à risque ʺRev Prescrire 2011 ;31(331) :346-347.
- méthotrexate par voie orale : prévenir les surdoses par erreurʺRev Prescrire 2007 ; 27(283) :352-355..
- http://www.patientensicherheit.ch/fr/publications/Quick-Alerts.html
- www.ansm.santé.fr
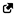
Stimulateur Cardiaque Double Chambre
Marque : Adapta,Versa, Sensia, Relia ,Atesta, Sphera, Vitatron Séries A/E/G/Q, des laboratoires Medtronic.
Une note d’information urgente de sécurité a été publiée par l’ANSM en : Janvier 2019
Qui comporte un rappel volontaire et d’une suspension de distribution affectant un sous-ensemble de pacemakers double chambre Medtronic distribués dans le monde entier entre le 10 mars 2017 et le 7 janvier 2019 sous les de marque suscitées
Description du problème : les dispositifs du sous-ensemble affecté, lorsqu’ils sont programmés en mode double chambre avec une détection auriculaire, peuvent être sujets à une erreur de circuit qui affecte les fonctionnalités du dispositif.
Pour que cette erreur se produise, une unique combinaison d’événements doit avoir lieu pendant que le dispositif traite un événement de détection auriculaire.si une telle erreur se produit, le produit sera incapable de fournir une stimulation jusqu’à ce qu’un événement de détection ventriculaire soit détecté.
Medtronic avait connaissance de quatre(04) cas signalés chez deux (02) patients où une pause dans la thérapie de stimulation est apparue cliniquement en raison de cette erreur de circuit. Les cas signalés se sont produits pour trois (03) dispositifs sur un total de 156,957 dispositifs vendus dans le monde entier ; aucun décès n’a été signalé à la suite de cette défaillance.
Pour plus d’information veuillez consulter le : https://www.ansm.sante.fr
Dernière mise à jour : Avril 2019
Recommandations d’utilisation du Déférasirox (DEFEROX®) comprimé dispersible à 125mg, 250mg ou 500mg
I. Indications :
Le déférasirox est indiqué dans le traitement de la surcharge en fer chronique secondaire à des transfusions sanguines lorsque:
1. Elles sont fréquentes (≥7 ml/kg/mois de concentrés érythrocytaires) chez les patients de 6 ans et plus présentant une ß-thalassémie majeure.
2. Le traitement par la déféroxamine est contre-indiqué ou inadapté chez les groupes de patients suivants :
‐ Patients présentant d'autres anémies ;
‐ Patients âgés de 2 ans à 5 ans ;
‐ Patients présentant une ß-thalassémie majeure avec une surcharge en fer chronique secondaire à des transfusions sanguines peu fréquentes (< 7 ml/kg/mois de concentrés érythrocytaires).
Le traitement a pour but d'éliminer le fer apporté par les transfusions et si nécessaire de réduire la surcharge en fer existante.
II. Mode d'utilisation:
1. Le Deferox® doit être pris une fois par jour,à jeun, au moins 30 minutes avant de prendre un repas, de préférence à la même heure tous les jours.
2. Les comprimés doivent être complètement dissous dans un verre d'eau, de jus d'orange ou de jus de pomme (100 ml à 200 ml). Toute quantité restante doit être remise en suspension avec un peu d'eau ou de jus de fruit puis avalée.
III. Posologie:
‐ Le traitement devrait être initié:
· Après une transfusion d'environ 20 unités de concentrés érythrocytaires (soit 100 ml/kg).
· Lorsque le suivi clinique met en évidence la présence d'une surcharge en fer (par exemple ferritinémie > 1000 μg/l).
‐ Les doses doivent être calculées en mg/kg et arrondies au dosage du comprimé le plus proche.
Dose initiale :
‐ La dose initiale recommandée est de 20 mg/kg/j.
‐ Une dose initiale de 30 mg/kg/j peut être envisagée pour les patients qui reçoivent plus de 14 ml/kg/mois de concentrés érythrocytaires.
‐ Une dose initiale de 10 mg/kg/j peut être envisagée pour les patients qui reçoivent moins de 7 ml/kg/mois de concentrés érythrocytaires.
‐ Chez les patients déjà bien équilibrés avec un traitement par la déféroxamine, une dose initiale de déférasirox (la moitié de celle de la déféroxamine) pourra être envisagée.
Si la dose journalière résultante est de moins de 20 mg/kg/j, une augmentation de la dose devra être envisagée en cas d’une réponse insuffisante.
Dose d'entretien :
‐ Contrôle de la ferritinémie tous les mois.
‐ L’ajustement de la dose de déférasirox se fait tous les 3 mois à 6 mois en fonction des variations de la ferritinémie.
Les ajustements doivent être :
- réalisés par paliers de 5 à 10 mg/kg.
· adaptés à la réponse individuelle du patient et aux objectifs thérapeutiques.
‐ Des doses allant jusqu'à 40 mg/kg peuvent être envisagées chez les patients qui ne sont pas correctement contrôlés à des doses de 30 mg/kg (par exemple ferritinémie persistant en-dessus de 2500 μg/l et n'ayant pas tendance à diminuer avec le temps).
‐ À des doses supérieures à 30 mg/kg, d’autres options thérapeutiques sont à envisager si :
· Un très faible contrôle de l'hémosidérose est atteint.
- Si un contrôle satisfaisant n'est pas atteint.
‐ Les données d'efficacité et de sécurité d'emploi à long terme avec des doses de déférasirox supérieures à 30 mg/kg sont actuellement limitées, des doses supérieures à 40 mg/kg sont déconseillées.
‐ Chez les patients traités à des doses supérieures à30 mg/kg, des réductions de dose par paliers de 5 à 10 mg/kg devront être envisagées quand le contrôle a été atteint (par exemple ferritinémie persistant au-dessous de 2500 μg/l et ayant tendance à diminuer avec le temps).
‐ Chez les patients pour lesquels la ferritinémie a atteint son objectif (habituellement entre 500 et 1000 μg/l), des réductions de dose par paliers de 5 à 10 mg/kg devront être envisagées afin de maintenir la ferritinémie dans ces valeurs cibles.
‐ L'interruption du traitement doit être envisagée si la ferritinémie chute de façon persistante en dessous de 500 μg/l.
Dernière Mise à jour : octobre 2017
Localisation du CNPM
Photo du centre

Contacter nous
CNPM, Sis Route Petit Staoueli (NIPA) Dely Ibrahim Alger, Tél. / Fax : 00 213 20 39 66 18 / 00 213 20 39 66 16
Mail : cnpm@cnpm.org.dz






